新闻及香港科大故事
2021
新闻
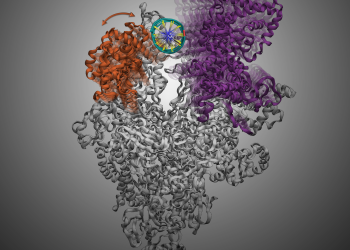
HKUST Scientists Discover How Antibiotics Target Bacterial RNAP to Inhibit Its Gene Transcription(只供英文版本)
A group of researchers at the Hong Kong University of Science and Technology (HKUST) has uncovered the mechanism of how DNA is being melted to start bacterial gene transcription and how one class of antibiotics inhibits this process – an important way in killing bacteria. This discovery provides useful insight on the development of new antibiotics for bacteria that is antimicrobial resistance.
新闻
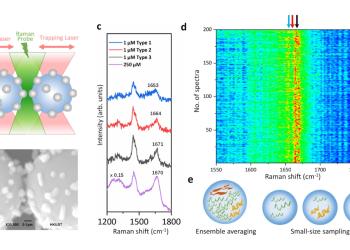
HKUST Researchers Develop a Novel Raman Spectroscopy Platform to Characterize Intrinsically Disordered Proteins in Dilute Solution (只供英文版本)
It is challenging to analyze proteins at low concentrations, especially for those in a mixture of various conformations such as intrinsically disordered proteins (IDPs). A research team led by Prof. HUANG Jinqing, Assistant Professor of Department of Chemistry at The Hong Kong University of Science and Technology (HKUST), has developed optical tweezers-coupled Raman spectroscopy that can directly probe the structural features of alpha-synuclein, an IDP closely linked to Parkinson’s disease, at the physiological concentration by focusing on individual protein molecules.
新闻
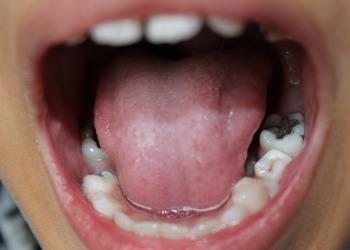
科大破解人类口腔微生物合成次生代谢小分子促进牙菌斑形成的奥秘
由香港科技大学(科大)海洋科学系及生命科学部讲座教授钱培元带领的一支跨学科研究团队,揭示了人类口腔变形链球菌(Streptococcus mutans)释放出的新型微生物小分子与龋齿的发展有关,为人类口腔微生物群对健康的影响提供了新的科学证据,推动了未来预防龋齿的研究。现该研究成果已发表在权威前沿科学杂志Nature Chemical Biology, 并获Nature以亮点研究进行报道 。
生物膜(biofilm)是由细菌胞外大分子包裹的细菌群体组成;地球上每一个湿润的表面都被生物膜所覆盖。美国国家卫生研究院(National Institutes of Health)早期研究表明,超过80%的人类细菌感染是由生物膜引起的。 变形链球菌是生存在人类口腔的主要天然菌,因其具有形成生物膜和产生有机酸的能力,其长期以来一直被认为是龋齿的主要病原。
龋齿是困扰人类的最常见的慢性细菌感染疾病之一,且治疗费用昂贵。全球每年用于治疗龋齿的经济支出高达数十亿美元 。龋齿的发展是一个复杂的过程,主要依赖于牙齿表面微生物生物膜(又稱牙菌斑)的形成。尽管变形链球菌中关于生物膜形成和发展的大分子已被广泛研究,但小分子次生代谢产物在这种细菌生物膜形成中的作用仍未被深入探究。
钱教授的研究团队致力于运用基因组学、转录组学和化学生物学的方法,研究生物膜的信号分子如何调控微生物及动物間的相互作用。最近,该团队将生物膜研究拓展到公共卫生领域。











